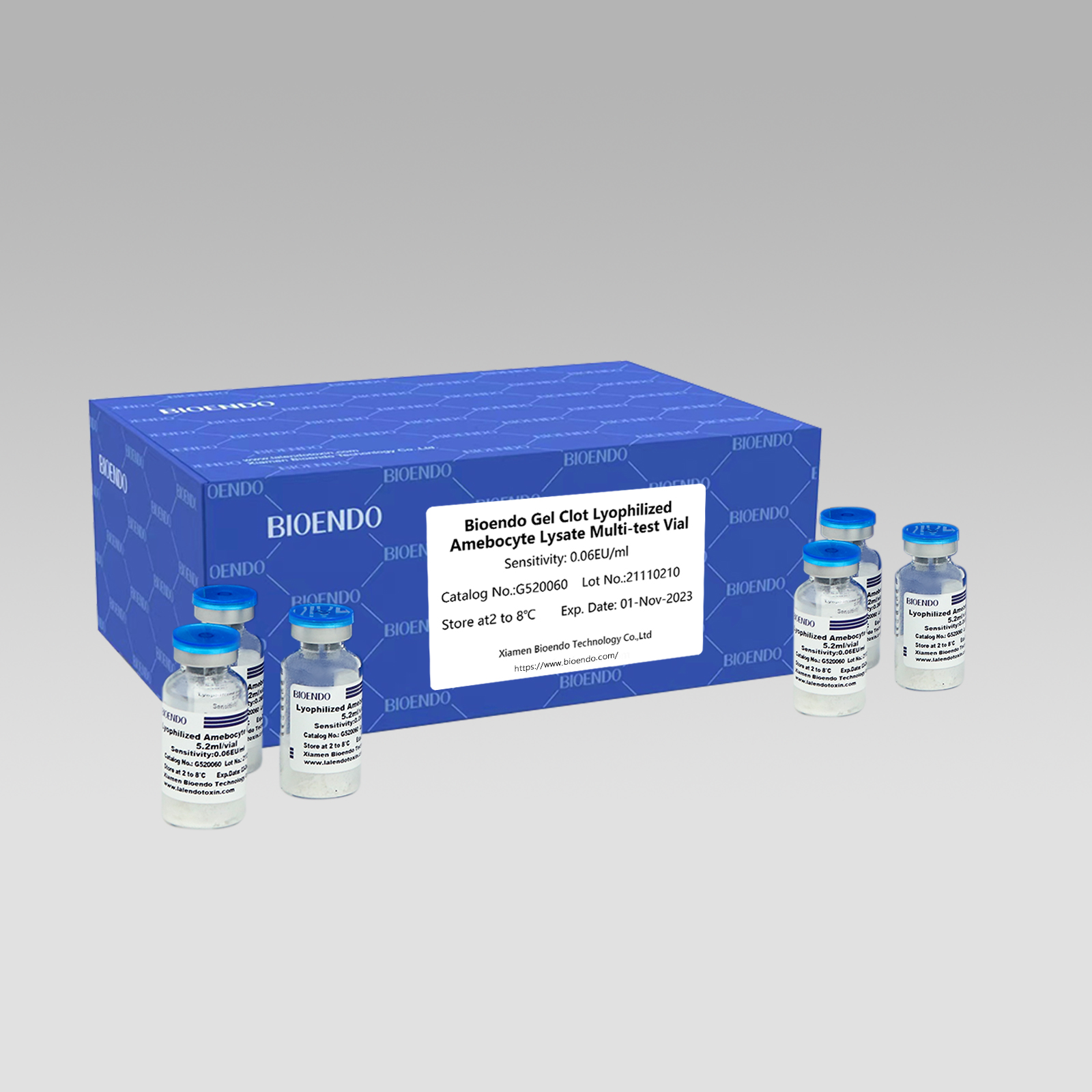
Gel Clot Lyophilized Amebocyte Lysate Multi-test Vial G52
Ang serye sa Bioendo G52 kasagarang gigamit sa operasyon sa eksperimento sapagsulay sa endotoxin sa bakteryaisip pamaagi sa Bioassay.
1. Impormasyon sa Produkto
Ang pamaagi sa Gel Clot Lyophilized Amebocyte Lysate Multi-test Vial mao ang Lyophilized Amebocyte Lysate reagent nga nagpili ug naggamit sa teknik sa gel clot aron mahibal-an ang endotoxin o pyrogen.
Ingon nga kaylap nga pamaagi, ang gel-clot nga pagsulay alang sa endotoxin yano ug wala magkinahanglan piho ug mahal nga instrumento.Naghatag ang Bioendo og Gel Clot Lyophilized Amebocyte Lysate - LAL reagent sa 5.2ml matag vial.
2. Mga Parametro sa Produkto
Sakup sa pagkasensitibo: 0.03EU/ml, 0.06EU/ml, 0.125EU/ml, 0.25EU/ml, 0.5 EU/ml
3. Aplikasyon sa Produkto
End-product endotoxin (pyrogen) kwalipikasyon, tubig alang sa indeyksiyonendotoxin assay, hilaw nga materyalpagsulay sa endotoxino pagmonitor sa lebel sa endotoxin sa panahon sa proseso sa paggama alang sa mga kompanya sa parmasyutiko o mga tiggama sa medikal nga aparato.
Mubo nga sulat:
Ang Lyophilized Amebocyte Lysate (LAL reagent) nga gigama sa Bioendo gihimo gikan sa lysate sa amebocytes (white blood cells) gikan sa horseshoe crab.
Kini nga talagsaon nga reagent nahimo nga usa ka hinungdanon nga himan sa industriya sa parmasyutiko ug medikal nga aparato alang sa pag-ila sa mga endotoxin sa bakterya.Ang mga amebocyte sa horseshoe crab adunay substansiya nga gitawag og Lyophilized Amebocyte Lysate, nga mo-react sa bacterial endotoxins pinaagi sa pagporma og gel-like clot.Kini nga reaksyon mao ang sukaranan sa pagsulay sa LAL, nga gigamit aron masiguro ang kaluwasan sa mga medikal nga aparato, tambal, ug uban pang mga produkto nga adunay kontak sa lawas sa tawo.
Ang paggamit sa LAL reagent nakapabag-o sa proseso sapagtuki sa endotoxinsa medikal nga natad kay sa Rabit test assay.Ang dili hitupngan nga pagkasensitibo ug espesipiko niini naghimo niini nga usa ka hinungdanon nga sangkap sa pagkontrol sa kalidad ug kasiguruhan sa kaluwasan sa mga parmasyutiko, biologics, ug mga medikal nga aparato.Ang LAL nga pagsulay usa ka paspas ug kasaligan nga pamaagi alang sapagtuki sa endotoxin, nga naghatag mga resulta sa labing gamay nga 60 minuto.Kini nga kahusayan nagtugot sa dali ug tukma nga mga desisyon bahin sa pagpagawas sa mga produkto, nga sa katapusan nagpauswag sa kinatibuk-ang kaluwasan ug kaepektibo sa mga medikal nga pagtambal ug mga aparato.
Ang Lyophilized Amebocyte Lysate (LAL reagent) sa Bioendo gihimo ubos sa higpit nga kalidad nga mga sumbanan aron masiguro ang pagkaepektibo ug kasaligan niini.Ang kompanya gipahinungod sa paggamit sa malungtarong mga gawi sa pag-ani sa mga horseshoe crab aron maminusan ang bisan unsang negatibo nga epekto sa ilang populasyon.Pinaagi sa pag-una sa kaayohan niining mga binuhat, gisiguro sa Bioendo ang padayon nga suplay niining bililhong kapanguhaan alang sa paggama sa LAL reagents.Dugang pa, ang nagpadayon nga panukiduki ug mga paningkamot sa pag-uswag naka-focus sa pagpaayo sa pasundayag ug kaarang saLAL pagsulay endotoxin, dugang nga pag-uswag sa ilang utility sa medikal ug pharmaceutical nga industriya.
Gel clot nga pamaagiPagsusi sa LAL, ang reconstituted lysate reagent makakuha ug labing menos 50 ka mga pagsulay matag panaksan:
| Numero sa Katalogo | Pagkasensitibo (EU/ml o IU/ml) | ml / panaksan | Mga Pagsulay/Val | Mga panaksan/Pakete |
| G520030 | 0.03 | 5.2 | 50 | 10 |
| G520060 | 0.06 | 5.2 | 50 | 10 |
| G520125 | 0.125 | 5.2 | 50 | 10 |
| G520250 | 0.25 | 5.2 | 50 | 10 |
| G520500 | 0.5 | 5.2 | 50 | 10 |
Kondisyon sa produkto:
Ang Lyophilized Amebocyte Lysate - LAL reagent sensitivity ug ang Control Standard Endotoxin potency gisulayan batok sa USP Reference Standard Endotoxin.Ang Lyophilized Amebocyte reagent kit adunay instruksyon sa produkto, Certificate of Analysis, MSDS.
Unsa ang kalainan tali sa Bioendo single test vial ug multiple test vial?
● Usa ka pagsulay: i-reconstitute ang singlepagsulay sa limulus lysateo gitawaglimulus amebocytepinaagi sa BET nga tubig sa glass vial o glass ampoule.
● Multi-test: i-reconstitute ang lysate reagent sa BET nga tubig, ug dayon idugang ang marka nga gidaghanon sa lysate reagent nga nagsunod sa COA sa reaction tube o well plate para magamit.Walay kalainan sa sample pre-processing procedure;sumala sa gidaghanon sa pagsulay nga gigamit, ang sample nga gidak-on nga gigamit alang sa usa ka pagsulay mas dako kaysa sa sample nga gidak-on nga gigamit alang sa daghang mga pagsulay.
Ngano nga ang gel clot assay kit G52 espesyal alang sa mass sample nga gidaghanon?
1. Multi test LAL reagent para sa endotoxin detection sa mga aplikasyon sa mass samples' LAL assay operation procedures.
2. G52 nga serye sa Gel clot endotoxin assay multi test glass vial dili na kinahanglan ang sopistikado nga microplate reader.Sa LAL assay ang pamaagi niini sa paglumlum pinaagi sa kaligoanan sa tubig o dry heat incubator maoy sayon nga himan.
3. Taas nga kalidad sa endotoxin free tube (<0.005EU/ml) ug Taas nga kalidad sa pyrogen free tips (<0.005EU/ml) isip garantisadong mga consumable aron masiguro ang hustong resulta.
4. Sa pagpili sa Bioendo single LAL test vial o multi LAL test vial pinaagi sa sample nga gidaghanon, ang target maoLAL test alang sa pyrogensdetection.
May kalabutan nga mga produkto sa endotoxin test assay:
Tubig para sa Bacterial Endotoxins Test (BET), Rekomend TRW50 o TRW100
Endotoxin free glass tube (pagtunaw tube), Rekomend T1310018 ug T107540
Pyrogen free tips, Rekomend PT25096 o PT100096
Pipettor, Rekomend PSB0220
Test Tube Rack
Incubator Instrumento (Water Bath o Dry Heat Incubator), aron irekomendar ang Bioendo Dry Heat Incubator TAL-M2 kay 60 ka buho ang usa ka modular.
Vortex Mixter, Girekomenda ang VXH.
Pagkontrol sa Standard Endotoxin, CSE10V.